Решение
Минимальное расстояние на которое сближаются при столкновении центры двух молекул равно диаметру молекулы d (это расстояние называется эффективным диаметром молекулы) смотри рисунок.
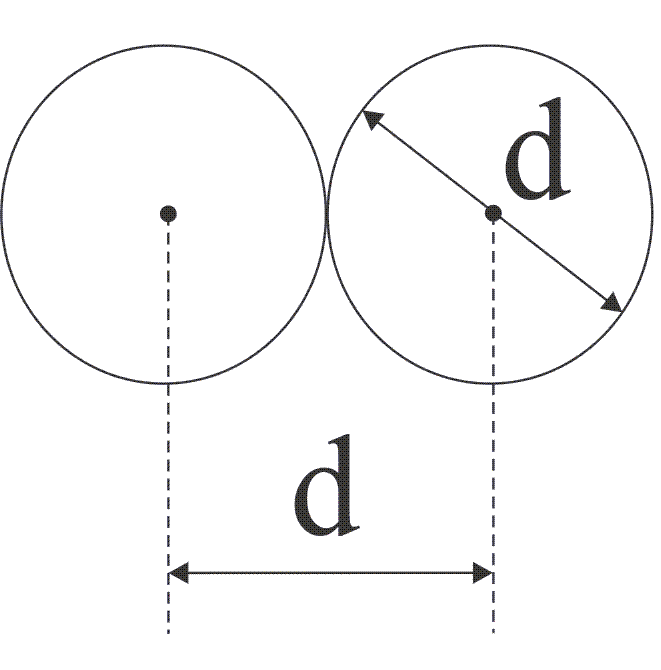
Для того, чтобы посчитать среднее число столкновений ν, предположим, что все молекулы , кроме данной застыли неподвижно на своих местах (тогда она движется со средней скоростью относительного движения отн>). Проследим за движением выделенной нами молекулы. Ударившись об одну из неподвижных молекул , она будет лететь прямолинейно до тех пор, пока не столкнется с какой-либо другой неподвижной молекулой смотри рисунок 2. Это соударение произойдёт в том случае, если центр неподвижной молекулы окажется от прямой, вдоль которой летит молекула, на расстоянии меньшем эффективного диаметра молекулы d. В результате столкновения молекула изменит направление своего движения, после чего некоторое время опять будет двигаться прямолинейно.
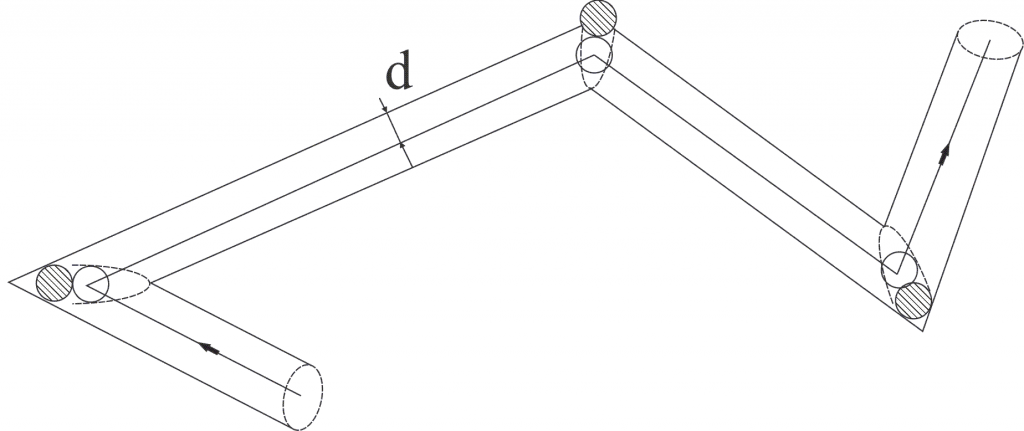
За секунду наша молекула проходит с среднем путь, равный средней скорости относительного движения <Vотн>. Число происходящих за это время соударений с неподвижными молекулами равно числу молекул, центры которых попадают внутри коленчатого цилиндра длины <Vотн> и радиуса d. Так как в газе расстояние между молекулами много больше их диаметра, мы можем считать объем цилиндра равным 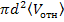 : Умножив этот объем на число молекул в единице объема n, получим среднее число столкновений за секунду движущейся молекулы с неподвижной.
: Умножив этот объем на число молекул в единице объема n, получим среднее число столкновений за секунду движущейся молекулы с неподвижной.
![]() , концентрация молекул n.
, концентрация молекул n.
